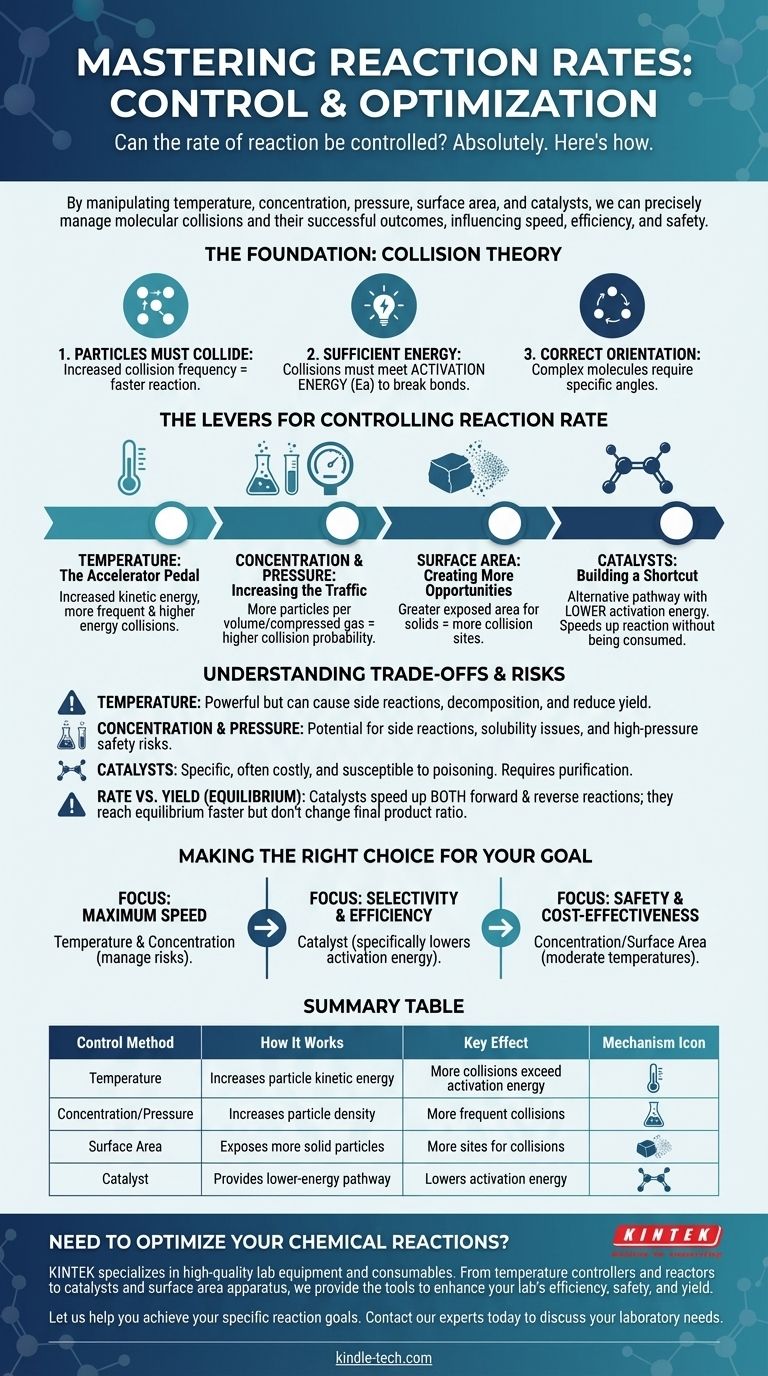
물론입니다. 화학 반응 속도는 고정된 특성이 아니며 정밀하게 제어될 수 있습니다. 특정 물리적 및 화학적 요인을 조작함으로써 반응을 의도적으로 가속화하거나 늦추거나 심지어 중단시킬 수 있습니다. 이러한 제어의 주요 조절 장치는 온도, 반응물의 농도, 압력(기체의 경우), 표면적(고체의 경우) 및 촉매의 도입입니다.
반응 속도를 제어하는 것은 근본적으로 분자 충돌의 빈도와 에너지를 관리하는 것입니다. 가열에서 촉매 추가에 이르기까지 모든 방법은 입자가 충돌하는 방식과 해당 충돌이 성공적인지 여부에 영향을 미쳐 작동합니다.
기초: 충돌 이론
반응을 제어하려면 먼저 반응이 일어나는 이유를 이해해야 합니다. 모든 반응 속도는 충돌 이론의 원리에 의해 지배되며, 이는 반응이 일어나기 위해 세 가지 조건이 충족되어야 함을 의미합니다.
1. 입자는 충돌해야 합니다
두 개 이상의 분자가 반응하려면 먼저 물리적으로 접촉해야 합니다. 입자가 더 자주 충돌할수록 반응할 기회가 더 많아져 반응 속도가 증가합니다.
2. 충돌은 충분한 에너지를 가져야 합니다
단순히 충돌하는 것만으로는 충분하지 않습니다. 충돌하는 입자는 활성화 에너지(Ea)라고 하는 최소한의 운동 에너지를 가지고 있어야 합니다. 이 에너지는 새로운 결합이 형성될 수 있도록 기존의 화학 결합을 끊는 데 필요합니다.
활성화 에너지보다 낮은 에너지로 충돌하는 것은 성공적이지 않을 것입니다. 입자는 단순히 서로 부딪혀 변하지 않은 채 튕겨 나갈 것입니다.
3. 입자는 올바른 방향을 가져야 합니다
복잡한 분자의 경우 충돌은 특정 각도나 방향으로 일어나야 합니다. 충돌 시 분자의 반응성 부분이 제대로 정렬되지 않으면 에너지 요구 사항이 충족되더라도 반응이 일어나지 않습니다.

반응 속도 제어의 조절 장치
충돌 이론을 이해하면 반응 속도를 조작하기 위한 명확한 로드맵을 얻을 수 있습니다. 각 제어 방법은 성공적인 충돌에 필요한 하나 이상의 조건을 변경하여 작동합니다.
온도: 가속 페달
온도를 높이면 입자의 평균 운동 에너지가 증가합니다. 이는 강력한 두 가지 효과를 가져옵니다.
첫째, 입자가 더 빠르게 움직이게 하여 충돌 빈도를 높입니다. 둘째, 그리고 더 중요하게는, 이러한 충돌 중 훨씬 더 많은 부분이 활성화 에너지와 같거나 그 이상의 에너지를 갖게 되어 성공적인 반응 속도가 극적으로 증가합니다.
농도 및 압력: 교통량 증가
용액에서 반응물의 농도를 높인다는 것은 동일한 부피에 더 많은 입자가 채워져 있음을 의미합니다. 이는 충돌 가능성을 직접적으로 증가시켜 반응 속도를 높입니다.
기체의 경우 압력을 높이는 것은 동일한 효과를 가져옵니다. 이는 기체 분자를 서로 가깝게 밀어붙여 사실상 농도를 증가시키고 더 잦은 충돌로 이어집니다.
표면적: 더 많은 기회 창출
이 요인은 고체가 액체 또는 기체와 반응할 때 중요합니다. 고체를 더 작은 조각(예: 단단한 덩어리에서 분말로)으로 부수면 총 표면적이 극적으로 증가합니다.
이는 고체의 더 많은 입자를 다른 반응물에 노출시켜 충돌이 일어날 수 있는 지점을 훨씬 더 많이 생성하고 전반적인 반응 속도를 증가시킵니다.
촉매: 지름길 구축
촉매는 공정에서 소모되지 않으면서 반응 속도를 증가시키는 물질입니다. 이는 더 낮은 활성화 에너지를 가진 대체 반응 경로를 제공함으로써 작동합니다.
촉매는 입자가 더 자주 또는 더 많은 에너지로 충돌하게 만들지 않습니다. 대신, 성공적인 충돌을 극복해야 하는 에너지 "장벽"을 낮추어 반응이 훨씬 더 쉽게 진행되도록 합니다.
상충 관계 및 위험 이해
이러한 조절 장치는 효과적이지만 단점이 없는 것은 아닙니다. 올바른 방법을 선택하려면 그 한계와 잠재적인 단점을 이해해야 합니다.
온도의 둔탁한 힘
열은 강력하지만 무차별적인 도구입니다. 원하는 반응 속도를 높일 수는 있지만 잠재적인 부반응 속도도 높일 수 있습니다. 매우 높은 온도에서는 반응물이나 생성물이 분해되어 전체 수율이 감소할 수도 있습니다.
농도 및 압력의 위험
높은 농도는 때때로 원치 않는 부반응이나 용해도 문제를 일으킬 수 있습니다. 더 중요하게는, 매우 높은 압력에서 작동하려면 잠재적인 밀봉 실패의 심각한 안전 위험을 관리하기 위해 전문적이고 비싸며 견고한 장비가 필요합니다.
촉매의 특이성과 비용
촉매는 종종 고도로 특이적이며 매우 비쌀 수 있습니다(예: 백금이나 팔라듐을 사용하는 촉매). 또한 촉매 피독이라고 하는 공정으로 인해 불순물에 의해 무용지물이 될 수 있으므로 반응물의 정제가 중요합니다.
속도 대 수율(평형)
반응 속도와 반응 수율을 구별하는 것이 중요합니다. 정반응과 역반응 모두 진행될 수 있는 가역 반응의 경우 촉매는 두 반응을 모두 동일하게 가속화합니다. 이는 평형에 더 빨리 도달하게 하지만 생성물 대 반응물의 최종 비율은 변경하지 않습니다.
목표에 맞는 올바른 선택
반응을 제어하는 최적의 전략은 속도, 효율성 또는 안전 등 특정 목표에 전적으로 달려 있습니다.
- 최대 속도가 주요 초점인 경우: 온도와 농도를 높이는 것이 가장 직접적인 도구이지만 부반응 및 안전 위험을 적극적으로 관리해야 합니다.
- 선택성과 효율성이 주요 초점인 경우: 촉매는 원하는 반응의 활성화 에너지를 낮추고 다른 반응을 촉진하지 않으므로 종종 최선의 선택입니다.
- 안전성과 비용 효율성이 주요 초점인 경우: 적당한 온도에서 농도 또는 표면적을 조작하는 것이 종종 가장 접근하기 쉽고 위험이 적은 방법입니다.
이러한 요소를 숙달하면 화학 반응을 고정된 사건에서 특정 결과를 달성하기 위해 정밀하게 지시할 수 있는 동적 프로세스로 변환할 수 있습니다.
요약표:
| 제어 방법 | 작동 방식 | 주요 효과 |
|---|---|---|
| 온도 | 입자 운동 에너지 증가 | 더 많은 충돌이 활성화 에너지 초과 |
| 농도/압력 | 입자 밀도 증가 | 더 잦은 충돌 |
| 표면적 | 더 많은 고체 반응물 입자 노출 | 더 많은 충돌 지점 |
| 촉매 | 더 낮은 에너지 반응 경로 제공 | 활성화 에너지 감소 |
화학 반응 최적화가 필요하십니까?
반응 속도를 정밀하게 제어하는 것은 성공적인 실험실 작업을 위한 핵심입니다. 합성을 가속화하든, 선택성을 개선하든, 안전한 작동을 보장하든, 올바른 장비가 필수적입니다.
KINTEK은 고품질 실험실 장비 및 소모품을 전문으로 공급하여 이러한 변수를 마스터할 수 있도록 돕습니다. 열과 압력을 관리하기 위한 정밀 온도 조절기 및 반응기부터 최적의 표면적 상호 작용을 위해 설계된 광범위한 촉매 및 장치에 이르기까지, 실험실의 효율성, 안전성 및 수율을 향상시키는 도구를 갖추고 있습니다.
귀하의 특정 반응 목표 달성을 도와드리겠습니다. 오늘 전문가에게 문의하여 실험실 요구 사항에 대해 논의하고 완벽한 솔루션을 찾으십시오.
시각적 가이드
관련 제품
- 고급 과학 및 산업 응용 분야를 위한 맞춤형 고압 반응기
- 다양한 과학적 응용 분야를 위한 맞춤형 실험실 고온 고압 반응기
- 실험실용 미니 SS 고압 오토클레이브 반응기
- 수열 합성용 고압 실험실 오토클브 반응기
- 고압 적용을 위한 온간 등압 성형기 WIP 워크스테이션 300Mpa



















