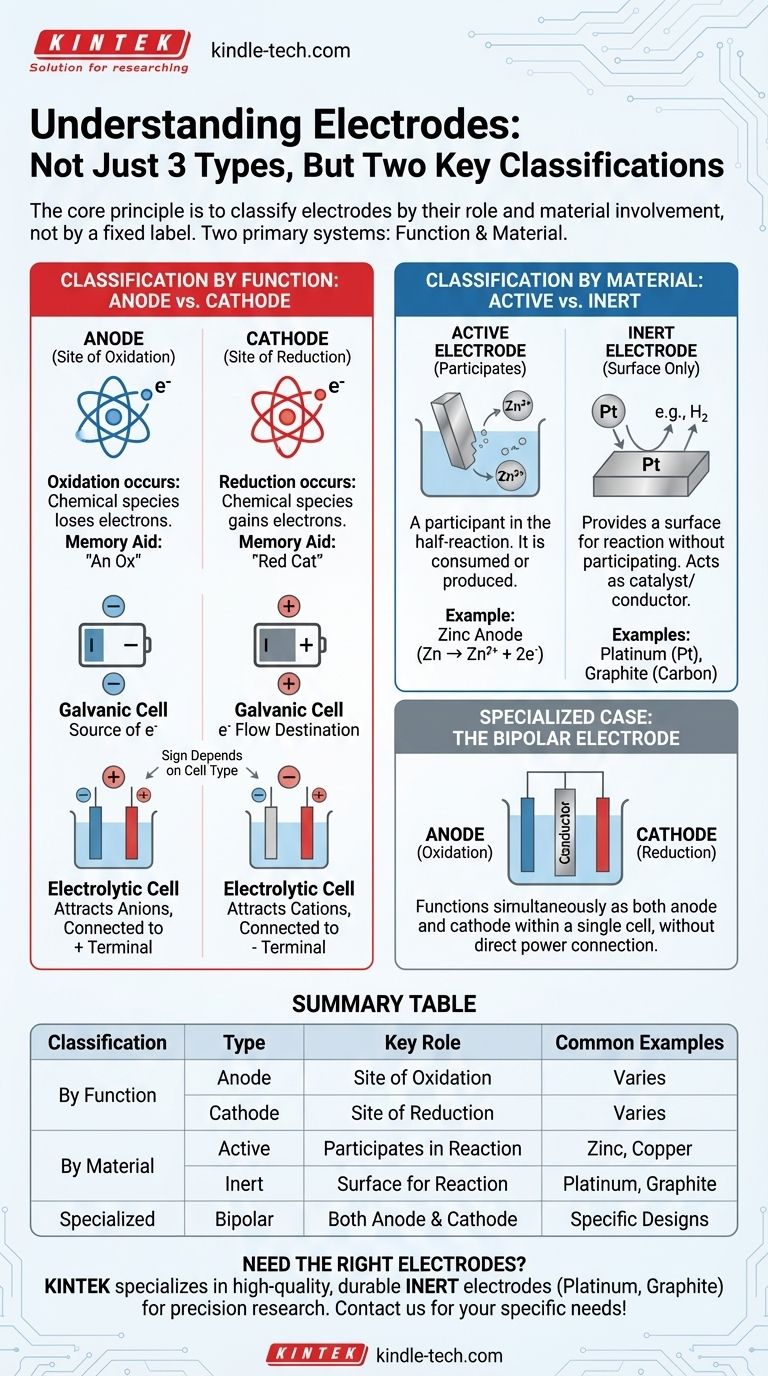
전기화학에서 전극은 세 가지 명확한 유형으로 이해되기보다는 두 가지 주요 분류 시스템을 통해 이해하는 것이 가장 좋습니다. 가장 기본적인 시스템은 전극을 기능에 따라 정의합니다. 즉, 산화가 일어나는 양극(anode) 또는 환원이 일어나는 음극(cathode)입니다. 두 번째로 중요한 시스템은 재료 구성과 반응에서의 역할에 따라 전극을 분류합니다. 즉, 활성(active)(반응에 참여하는) 또는 비활성(inert)(반응을 위한 표면을 제공하는)입니다.
핵심 원칙은 전극을 고정된 명칭이 아닌 역할에 따라 분류하는 것입니다. 가장 중요한 두 가지 분류는 기능(양극 대 음극)과 재료의 관여(활성 대 비활성)를 기반으로 합니다. 이 두 쌍을 이해하는 것이 모든 전기화학 전지를 분석하는 열쇠입니다.

기능별 분류: 양극 대 음극
전극을 정의하는 가장 기본적인 방법은 표면에서 일어나는 화학적 과정에 따른 것입니다. 이 역할은 전류의 흐름에 따라 달라질 수 있습니다.
양극: 산화가 일어나는 곳
양극(anode)은 산화(oxidation)가 일어나는 전극으로 정의됩니다. 이는 화학종이 전자를 잃는 과정입니다.
간단한 기억 보조 장치는 "An Ox" (Anode is Oxidation)입니다.
음극: 환원이 일어나는 곳
음극(cathode)은 환원(reduction)이 일어나는 전극입니다. 이는 화학종이 전자를 얻는 과정입니다.
해당 기억 보조 장치는 "Red Cat" (Reduction at the Cathode)입니다.
결정적인 차이: 부호 대 기능
흔한 혼동 지점은 양극과 음극이 양성인지 음성인지 여부입니다. 이는 전기화학 전지의 유형에 전적으로 달려 있습니다.
갈바니 전지(예: 배터리)에서
갈바니 전지는 자발적인 반응으로부터 전기를 생산합니다.
- 양극(Anode)은 음극 단자(-)입니다. 이는 산화 반응으로부터 전자의 원천입니다.
- 음극(Cathode)은 양극 단자(+)입니다. 이는 환원 반응을 일으키기 위해 전자가 흐르는 곳입니다.
전해 전지(예: 도금)에서
전해 전지는 외부 전기를 사용하여 비자발적인 반응을 유도합니다.
- 양극(Anode)은 양극 단자(+)입니다. 이는 전원 공급 장치의 양극 끝에 연결되어 음이온을 끌어들여 산화됩니다.
- 음극(Cathode)은 음극 단자(-)입니다. 이는 전원 공급 장치의 음극 끝에 연결되어 양이온을 끌어들여 환원됩니다.
재료별 분류: 활성 대 비활성
두 번째 주요 분류는 전극 재료 자체가 화학 반응의 일부인지 여부를 설명합니다.
활성 전극
활성 전극(active electrode) (또는 반응성 전극)은 반쪽 반응에 참여하는 전극입니다. 이는 산화되거나 환원의 생성물인 재료로 만들어집니다.
예를 들어, 아연-구리 배터리에서 아연 양극은 물리적으로 아연 이온으로 용해됩니다(Zn → Zn²⁺ + 2e⁻). 전극 자체가 소모됩니다.
비활성 전극
비활성 전극(inert electrode)은 반응 자체에 참여하지 않고 산화 또는 환원이 일어날 표면을 단순히 제공합니다. 이는 촉매 및 전기 전도체 역할을 합니다.
일반적인 비활성 전극에는 백금(Pt)과 흑연(탄소)이 포함됩니다. 이들은 산화되거나 환원되는 종이 용액 내의 이온이나 기체일 때 사용됩니다.
특수 사례: 양극성 전극
양극성 전극(bipolar electrode)은 전원 공급 장치에 직접 연결되지 않은 전해질 용액에 배치된 특수 전도체입니다.
이는 주 음극을 향하는 면에서는 양극으로, 주 양극을 향하는 면에서는 음극으로 동시에 기능하여 단일 전지 내에서 일련의 반응을 가능하게 합니다.
올바른 결정 내리기
전극에 대한 이해는 전기화학 시스템을 분석하는 방법을 안내해야 합니다. 전극의 "유형"은 전지 내에서의 맥락에 따라 정의됩니다.
- 배터리(갈바니 전지)를 분석하는 경우: 산화가 일어나는 곳을 음극 양극으로, 환원이 일어나는 곳을 양극 음극으로 식별합니다.
- 전해 과정(예: 전기 도금)을 분석하는 경우: 양극 단자에 연결된 전극을 양극(산화)으로, 음극 단자에 연결된 전극을 음극(환원)으로 식별합니다.
- 실험을 설계할 때: 반응에 참여하는 활성 전극이 필요한지 아니면 용액에 이미 있는 종들 사이의 반응을 단순히 촉진하는 비활성 전극이 필요한지 결정해야 합니다.
기능과 재료의 관여에 집중함으로써 모든 전기화학 시스템에서 모든 전극의 동작을 정확하게 설명하고 예측할 수 있습니다.
요약표:
| 분류 | 유형 | 주요 역할 | 일반적인 예 |
|---|---|---|---|
| 기능별 | 양극 | 산화가 일어나는 곳 (전자를 잃음) | 전지 유형에 따라 다름 |
| 음극 | 환원이 일어나는 곳 (전자를 얻음) | 전지 유형에 따라 다름 | |
| 재료별 | 활성 | 반응에 참여함 | 아연, 구리 |
| 비활성 | 반응을 위한 표면 제공 (비반응성) | 백금, 흑연 | |
| 특수 | 양극성 | 양극과 음극 모두로 기능함 | 특정 전지 설계에 사용됨 |
전기화학 응용 분야에 적합한 전극이 필요하십니까? KINTEK은 실험실의 정밀도와 신뢰성을 위해 설계된 백금 및 흑연으로 만든 내구성 있는 비활성 전극을 포함하여 고품질 실험실 장비 및 소모품을 전문으로 합니다. 당사의 전문가가 귀하의 연구 또는 공정에 완벽한 구성 요소를 선택하는 데 도움을 드릴 것입니다. 지금 문의하십시오 귀하의 특정 요구 사항을 논의하기 위해!
시각적 가이드