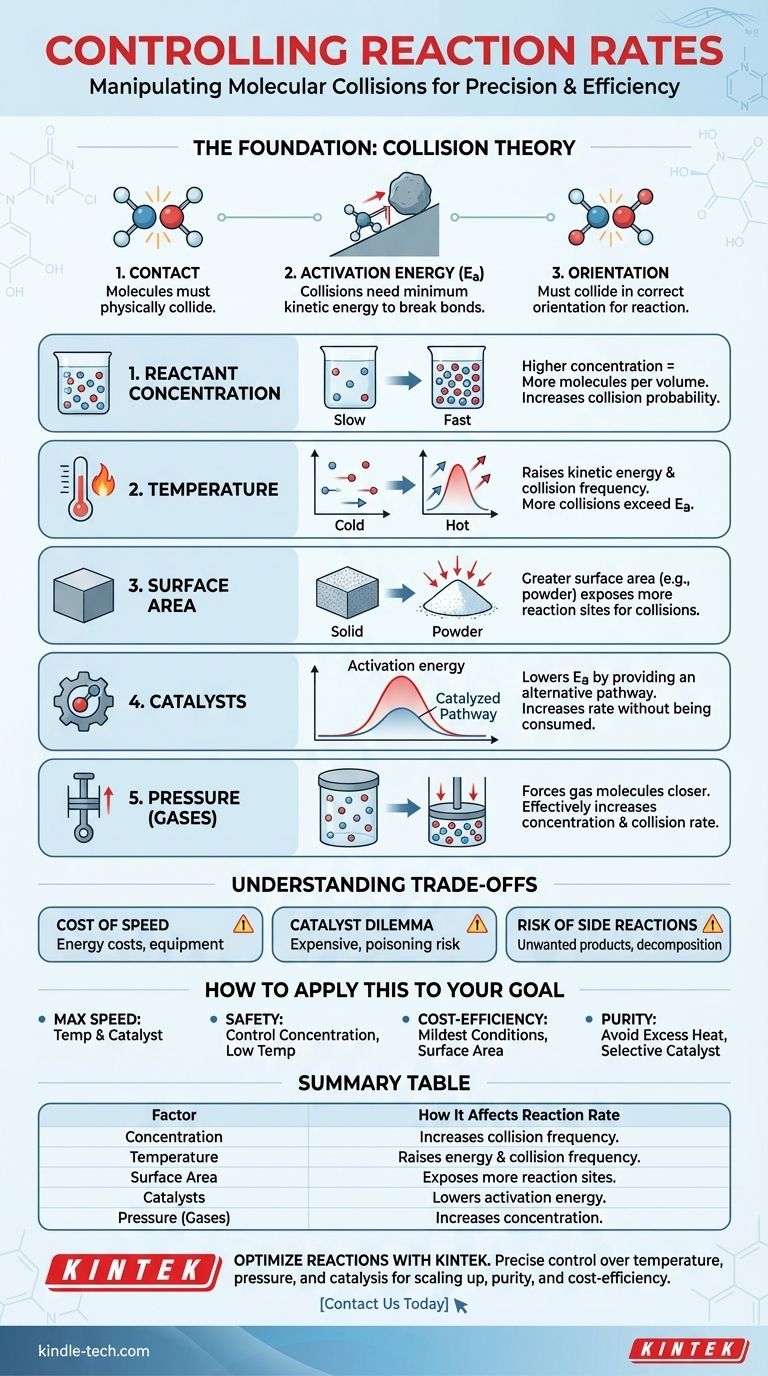
본질적으로 5가지 주요 요인이 화학 반응 속도를 결정합니다: 반응물의 농도, 온도, 반응물의 물리적 상태 및 표면적, 촉매의 존재 여부, 그리고 기체의 경우 압력입니다. 이 모든 요인은 분자 충돌의 빈도와 에너지에 영향을 미치며, 이는 모든 화학 변화의 근본적인 동인입니다.
모든 화학 반응의 속도는 반응물 분자들이 올바른 방향으로, 그리고 반응의 활성화 에너지 장벽을 극복할 만큼 충분한 에너지로 충돌하는 빈도에 의해 결정됩니다. 반응 속도를 제어하는 모든 것은 단순히 이러한 충돌의 빈도와 효과를 조작하는 지렛대일 뿐입니다.
기초: 충돌 이론
반응을 제어하려면 먼저 반응이 즉각적인 사건이 아니라는 것을 이해해야 합니다. 반응은 분자 간의 물리적 상호 작용의 결과입니다. 이는 충돌 이론으로 설명됩니다.
접촉의 필요성
반응이 일어나려면 반응물 분자들이 서로 물리적으로 충돌해야 합니다. 분리된 용기에 있다면 반응이 일어날 수 없습니다. 반응 속도는 이러한 충돌 속도와 직접적으로 연결됩니다.
에너지 요구 사항 (활성화 에너지)
충돌만으로는 충분하지 않습니다. 충돌하는 분자들은 활성화 에너지(Ea)라고 불리는 특정 최소량의 운동 에너지를 가지고 있어야 합니다. 이 에너지는 새로운 결합이 형성될 수 있도록 기존의 화학 결합을 끊는 데 필요합니다.
활성화 에너지를 바위 굴리기 위해 밀고 올라가야 하는 언덕이라고 생각해 보세요. 가벼운 밀침(낮은 에너지 충돌)은 아무 소용이 없습니다. 언덕 꼭대기까지 도달할 수 있도록 충분한 밀침(충분한 에너지)을 제공해야 하며, 그 후에는 반대편으로 굴러 내려가 에너지를 방출할 수 있습니다.
방향 요소
마지막으로, 분자들은 올바른 결합이 끊어지고 새로운 결합이 형성될 수 있도록 특정 방향으로 충돌해야 합니다. 충분한 에너지를 가지고 있더라도 잘못된 각도로 무작위로 충돌하면 반응이 일어나지 않습니다.

반응 속도 제어를 위한 다섯 가지 지렛대
충돌 이론을 이해하면 반응 속도를 높이거나 늦추기 위해 당길 수 있는 다섯 가지 뚜렷한 지렛대를 얻게 됩니다. 각 지렛대는 충돌 빈도, 충돌 에너지 또는 활성화 에너지 장벽 자체에 영향을 미쳐 작동합니다.
1. 반응물 농도
반응물의 농도를 높인다는 것은 주어진 부피 내에 더 많은 분자가 채워져 있다는 것을 의미합니다. 이는 분자들이 충돌할 확률을 직접적으로 증가시켜 반응 속도를 높입니다.
2. 온도
온도를 높이는 것은 강력한 두 가지 효과를 가집니다. 첫째, 분자의 운동 에너지를 증가시켜 더 빠르게 움직이고 더 자주 충돌하게 만듭니다. 둘째, 그리고 더 중요하게는, 이러한 충돌의 에너지를 증가시켜 더 높은 비율의 충돌이 활성화 에너지 장벽을 극복할 만큼 충분한 에너지를 갖게 합니다.
3. 물리적 상태 및 표면적
이는 고체와 액체(불균일 반응)가 반응하는 경우와 같이 서로 다른 상을 포함하는 반응에 가장 관련이 있습니다. 고체 덩어리는 충돌이 일어날 수 있는 표면적이 제한적입니다. 동일한 덩어리를 고운 가루로 분쇄하면 표면적이 극적으로 증가하여 더 많은 분자가 노출되고 반응이 일어날 수 있는 지점이 훨씬 더 많이 생성됩니다.
4. 촉매
촉매는 공정에서 소모되지 않으면서 반응 속도를 증가시킵니다. 이는 더 낮은 활성화 에너지를 가진 대체 반응 경로를 제공함으로써 이를 수행합니다.
우리의 비유로 돌아가면, 촉매는 언덕을 뚫는 터널을 만드는 것과 같습니다. 더 이상 바위를 언덕 꼭대기까지 밀 필요가 없습니다. 훨씬 적은 노력으로 반대편으로 이동할 수 있습니다. 이를 통해 더 낮은 온도에서도 더 많은 분자가 성공적으로 반응할 수 있습니다.
5. 압력 (기체 반응의 경우)
기체를 포함하는 반응의 경우, 압력을 높이면 기체 분자들이 서로 더 가깝게 밀집됩니다. 이는 효과적으로 농도를 높이는 것과 같으며, 더 잦은 충돌과 더 빠른 반응 속도로 이어집니다.
상충 관계 이해하기
반응 속도를 조작하는 데는 대가가 따릅니다. 효과적인 기술 자문가는 각 선택의 실제적, 경제적 영향을 고려해야 합니다.
속도의 대가
온도와 압력을 높이려면 에너지가 필요하며, 이는 비용이 듭니다. 또한 건설 및 유지 보수가 비싼 특수 고압 반응기가 필요할 수 있으며, 이는 안전 문제를 야기합니다.
촉매 딜레마
촉매는 매우 효과적일 수 있지만 종종 비쌉니다(예: 백금이나 팔라듐과 같은 귀금속 사용). 또한 하나의 반응에 매우 특이적일 수 있으며, "촉매 피독"이라고 하는 과정을 통해 불순물에 의해 비활성화될 수 있습니다.
원치 않는 부반응의 위험
반응을 너무 세게 몰아붙이면, 특히 과도한 열을 가하면 바람직하지 않은 결과가 초래될 수 있습니다. 반응물이나 생성물이 분해되기 시작할 수 있으며, 증가된 에너지는 원치 않는 부반응을 유발하여 원하는 생성물의 순도와 수율을 감소시킬 수 있습니다.
목표에 적용하는 방법
반응을 제어하는 전략은 달성하려는 목표에 전적으로 달려 있습니다.
- 주요 초점이 최대 속도인 경우: 가장 강력한 지렛대는 온도 증가와 효과적인 촉매 사용입니다. 이 두 가지 모두 성공적이고 에너지 있는 충돌 횟수를 극적으로 증가시키기 때문입니다.
- 주요 초점이 안전 및 제어인 경우: 반응물 농도를 신중하게 관리하고(예: 한 반응물을 다른 반응물에 천천히 첨가) 가장 낮은 유효 온도를 사용하는 것이 최선의 접근 방식입니다.
- 주요 초점이 비용 효율성인 경우: 가능한 가장 온화한 조건에 대해 최적화하십시오. 여기에는 저렴한 촉매를 찾거나 표면적을 늘려 극심한 열과 압력의 높은 에너지 비용을 피하는 것이 포함될 수 있습니다.
- 주요 초점이 제품 순도인 경우: 분해나 부반응을 일으킬 수 있는 과도하게 높은 온도를 피하고, 촉매가 원하는 반응에 대해 매우 선택적인지 확인하십시오.
궁극적으로 화학 반응을 제어하는 것은 분자 충돌을 지배하는 조건을 정밀하게 관리하는 기술입니다.
요약표:
| 요소 | 반응 속도에 미치는 영향 |
|---|---|
| 농도 | 농도가 높을수록 반응물 분자 간의 충돌 빈도가 증가합니다. |
| 온도 | 분자 에너지를 높이고 충돌 빈도를 높이며, 더 많은 충돌이 활성화 에너지를 초과합니다. |
| 표면적 | 표면적이 넓을수록(예: 분말 고체) 충돌을 위한 반응 부위가 더 많이 노출됩니다. |
| 촉매 | 대체 반응 경로를 제공하여 활성화 에너지를 낮춥니다. |
| 압력 (기체) | 기체 분자 농도를 증가시켜 더 잦은 충돌로 이어집니다. |
KINTEK의 정밀 장비로 화학 반응을 최적화하세요. 생산 규모 확대, 제품 순도 보장 또는 비용 효율성 극대화 등 어떤 목표를 가지고 있든, 당사의 실험실 장비 및 소모품은 반응 조건을 정밀하게 제어할 수 있도록 설계되었습니다. 당사의 전문가들이 귀하의 특정 요구 사항에 맞는 온도, 압력 및 촉매 작용을 관리하는 데 필요한 올바른 도구를 선택하도록 도와드리겠습니다. 귀하의 실험실 성공을 지원하는 방법에 대해 논의하려면 오늘 문의하십시오!
시각적 가이드
관련 제품
- 실험실용 미니 SS 고압 오토클레이브 반응기
- 스테인리스 고압 오토클레이브 반응기 실험실 압력 반응기
- 고급 과학 및 산업 응용 분야를 위한 맞춤형 고압 반응기
- 가열 플레이트가 있는 자동 가열 유압 프레스 기계, 실험실용 핫 프레스 25T 30T 50T
사람들이 자주 묻는 질문
- SPION 합성에서 고압 반응기의 기능은 무엇인가요? 정밀한 나노입자 엔지니어링 달성
- 배치형 반응기의 주요 부분은 무엇인가요? 6가지 필수 구성 요소에 대한 안내
- 고압 오토클레이브는 NiFe 산화물 합성에 어떤 역할을 합니까? 촉매 효율 최적화
- 이중 금속 합금 촉매 제조 시 자기 교반의 필요성은 무엇인가요? 최대 시너지 효과 달성.
- HA 제조에서 열수 환경의 중요성은 무엇인가요? 메조포러스 구조 및 순도 최적화
- SHS of Ti3SiC2에서 스테인리스강 압력 용기의 역할은 무엇인가요? 순도 보장 및 실시간 모니터링
- 반응기의 작동 압력은 얼마입니까? 귀하의 공정이 설계를 결정합니다
- 수열 반응기 사용의 기술적 이점은 무엇인가요? 메조다공성 HA 합성 및 반복성 숙달



