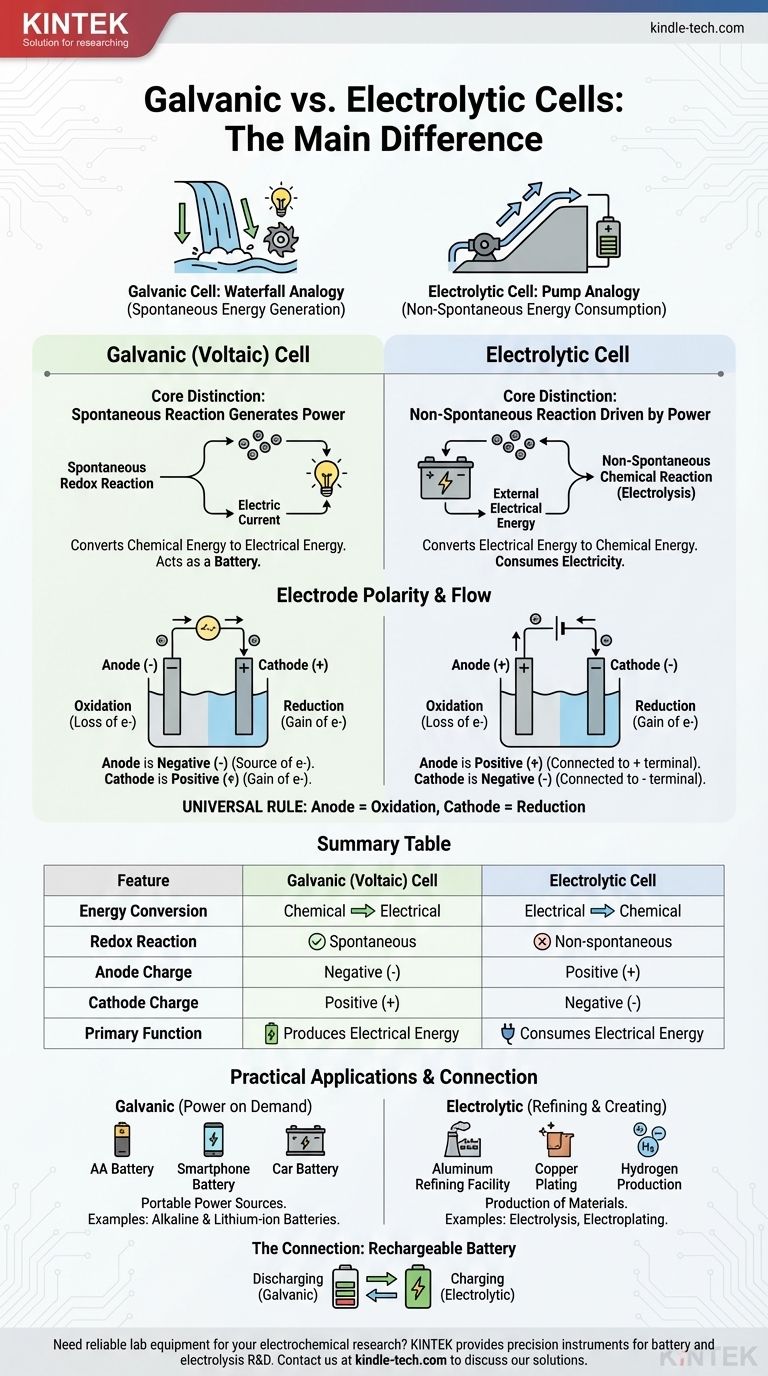
근본적인 차이점은 에너지 변환의 방향과 화학 반응의 성격에 있습니다. 갈바니 전지(Galvanic cell)는 저장된 화학 에너지를 자발적으로 전기 에너지로 변환하여 배터리처럼 작용합니다. 이와 대조적으로, 전기분해 전지(Electrolytic cell)는 외부 전기 에너지원을 사용하여 비자발적인 화학 반응이 일어나도록 구동합니다.
이를 발전기를 만드는 폭포와 동력을 사용하는 펌프의 차이로 생각할 수 있습니다. 갈바니 전지는 폭포와 같아서 자연적이고 자발적인 과정(물이 아래로 흐르는 것)이 에너지를 생성합니다. 전기분해 전지는 펌프와 같아서 외부 에너지를 사용하여 스스로 일어나지 않을 과정(물을 위로 밀어 올리는 것)을 강제합니다.

핵심적인 차이: 자발성과 에너지 흐름
이 두 전지의 거동은 한 가지 원리에 의해 지배됩니다. 즉, 내부의 산화-환원 반응이 스스로 일어나는지 여부입니다.
갈바니 전지: 전력을 생성하는 자발적 반응
전지(voltaic cell)라고도 불리는 갈바니 전지에서 선택된 화학 반응물은 서로 반응하려는 자연적인 경향을 가집니다.
이러한 자발적인 산화-환원 반응은 에너지를 방출합니다. 전지는 이 에너지를 열이 아닌 방향성 있는 전자 흐름, 즉 전류의 형태로 전환하도록 구성됩니다.
본질적으로 갈바니 전지는 자연적으로 발생하는 화학 공정을 활용하여 전기적 일을 수행합니다. 이것이 모든 배터리의 기본 원리입니다.
전기분해 전지: 동력에 의해 구동되는 비자발적 반응
전기분해 전지에서 화학 반응은 비자발적입니다. 반응물은 원하는 생성물을 만들기 위해 스스로 상호 작용하지 않을 것입니다.
반응이 일어나도록 하려면 외부 전원(배터리 또는 전원 공급 장치)이 전지에 연결됩니다. 이 외부 전압은 전자가 이동하고 화학적 변화를 유도하는 데 필요한 에너지를 제공합니다.
전기분해 전지는 화학 생성물을 만들기 위해 전기를 소비하며, 이 과정을 전기분해(electrolysis)라고 합니다.
전극 극성에 대한 심층 분석
"양극(anode)"과 "음극(cathode)"이라는 용어는 일정하지만, 두 전지 유형 간에 극성이 반전되기 때문에 그 전하(극성)는 혼동의 일반적인 지점입니다. 핵심은 전자 흐름을 구동하는 것이 무엇인지 기억하는 것입니다.
양극: 항상 산화가 일어나는 곳
두 전지 유형 모두에서 양극은 산화(전자의 손실)가 일어나는 전극으로 정의됩니다. 이 정의는 보편적입니다.
음극: 항상 환원이 일어나는 곳
마찬가지로 음극은 항상 환원(전자의 획득)이 일어나는 전극입니다. 이것이 두 번째 보편적인 규칙입니다.
결정적인 변화: 극성이 바뀌는 이유
극성의 차이는 반응이 자발적인지 강제적인지에 따라 발생합니다.
갈바니 전지에서는 양극에서의 자발적인 산화가 전자를 방출하여 음전하를 생성합니다. 양극은 회로로 전자를 밀어내는 근원이기 때문에 음극 단자가 됩니다.
전기분해 전지에서는 외부 전원이 사용됩니다. 이 전원의 양극 단자는 양극에서 전자를 끌어당겨 산화를 강제합니다. 따라서 양극은 양극 쪽에 연결되어 양극 단자가 됩니다.
| 특징 | 갈바니 (전지) 전지 | 전기분해 전지 |
|---|---|---|
| 에너지 변환 | 화학 → 전기 | 전기 → 화학 |
| 산화-환원 반응 | 자발적 | 비자발적 |
| 양극 전하 | 음성 (-) | 양성 (+) |
| 음극 전하 | 양성 (+) | 음성 (-) |
| 주요 기능 | 전기 에너지 생성 | 전기 에너지 소비 |
실제 응용 분야 이해하기
이러한 근본적인 차이는 기술 및 산업에서 뚜렷한 용도로 이어집니다.
작동하는 갈바니 전지: 필요할 때 전력 공급
갈바니 전지는 휴대용 전원 공급 장치로 설계되었습니다. 일반적인 예로는 표준 AA 알칼리 배터리부터 휴대폰의 리튬 이온 배터리에 이르기까지 모든 유형의 배터리가 있습니다.
작동하는 전기분해 전지: 정제 및 생성
전기분해 전지는 재료를 생산하기 위해 전력을 사용합니다. 알루미늄을 광석에서 추출하여 순수한 알루미늄을 생산하는 것, 구리를 정제하는 것, 물을 분해하여 수소와 산소 가스를 생산하는 것과 같은 주요 산업 공정은 전기분해에 의존합니다. 은이나 크롬과 같은 얇은 금속 층을 다른 물체 위에 증착하는 전기 도금(Electroplating)도 일반적인 응용 분야입니다.
연결 고리: 충전식 배터리가 작동하는 방식
충전식 배터리는 하나의 장치에서 두 가지 전지 유형을 모두 보여주는 완벽한 예입니다.
장치에 전원을 공급할 때(방전 시), 이는 갈바니 전지로 작동합니다. 배터리 내부의 자발적인 화학 반응이 전류를 생성합니다.
충전을 위해 플러그를 꽂을 때, 충전기는 외부 전원 공급 장치 역할을 합니다. 이는 비자발적인 역반응이 일어나 반응물을 보충하도록 강제하는 전압을 가합니다. 충전 중에는 배터리가 전기분해 전지로 기능합니다.
목표에 맞는 올바른 선택하기
귀하의 목표는 귀하가 사용하고 있는 전기화학적 프레임워크를 결정합니다.
- 화학 공정에서 전기를 생성하는 것이 주된 목표인 경우: 갈바니(전지) 전지를 설명하고 있는 것입니다.
- 특정 화학적 변화를 유도하기 위해 전기를 사용하는 것이 주된 목표인 경우: 전기분해 전지를 다루고 있는 것입니다.
- 충전식 배터리를 분석하는 경우: 방전 중에는 갈바니 전지로, 충전 중에는 전기분해 전지로 작동한다는 점을 기억하십시오.
궁극적으로 반응의 자발성과 결과적인 에너지 흐름의 방향이 이 두 가지 전기화학의 기둥을 구별하는 결정적인 특징입니다.
요약표:
| 특징 | 갈바니 (전지) 전지 | 전기분해 전지 |
|---|---|---|
| 에너지 변환 | 화학 → 전기 | 전기 → 화학 |
| 산화-환원 반응 | 자발적 | 비자발적 |
| 양극 전하 | 음성 (-) | 양성 (+) |
| 음극 전하 | 양성 (+) | 음성 (-) |
| 주요 기능 | 전기 에너지 생성 | 전기 에너지 소비 |
전기화학 연구를 위한 신뢰할 수 있는 실험 장비가 필요하신가요? 새로운 배터리 기술을 개발하든 전기분해 공정을 최적화하든 KINTEK은 귀하의 실험실에 필요한 정밀 기기와 소모품을 제공합니다. 당사의 솔루션이 귀하의 혁신에 어떻게 동력을 공급할 수 있는지 논의하려면 오늘 저희에게 연락하십시오!
시각적 가이드
관련 제품
- 코팅 평가용 전기화학 전해 셀
- 5구형 전기화학 전해조
- 수조가 있는 H형 이중층 광학 전해 전지
- 전해 전기화학 전지 가스 확산 액체 흐름 반응 전지
- 다기능 전기화학 전해조 수조 단층 이중층
사람들이 자주 묻는 질문
- 전기분해 전지와 전극은 유지보수를 위해 정기적으로 어떻게 청소해야 할까요? 신뢰할 수 있는 결과를 위한 가이드
- 아크릴 전해조 실험 시 작동 절차 및 안전 예방 조치는 무엇입니까? 실험실 안전을 위한 필수 가이드
- Sm2(Co,Fe,Cu,Zr)17 자석의 침출 공정에서 고정밀 전기화학 워크스테이션은 어떤 역할을 합니까?
- 3전극 전기화학 셀 시스템 사용의 장점은 무엇인가요? RuO2의 정밀한 특성 분석 달성
- XAS 전기화학 셀에 폴리에테르에테르케톤(PEEK)이 선택되는 이유는 무엇인가요? 화학적 불활성 및 정밀도 보장
- 아연-니켈(Zn-Ni) 합금 전해조에서 백금(Pt) 원통형 메쉬가 양극으로 선택되는 이유는 무엇인가요? 설명
- 탄소강에 전용 전기화학 테스트 셀이 필요한 이유는 무엇인가요? 지열 부식 데이터의 정확성을 보장합니다.
- 전기분해 셀 뚜껑은 일반적으로 어떤 재질로 만들어집니까? PTFE 및 POM 복합재 설명















