본질적으로 탄화규소(SiC)는 공유 결합 네트워크 고체입니다. 이는 기본 구조가 실리콘(Si)과 탄소(C) 원자로 구성된 거대한 3차원 결정 격자임을 의미합니다. 각 원자는 다이아몬드 구조와 매우 유사하게 반복되는 사면체 패턴으로 강력한 공유 결합에 의해 단단히 고정되어 있습니다. 이 배열은 폴리타입(polytypes)이라고 알려진 다양한 적층 변형으로 형성될 수 있습니다.
탄화규소의 구조에 대한 질문은 그 놀라운 특성을 이해하는 데 핵심적입니다. 단단하고 다이아몬드와 같은 공유 결합 네트워크는 탁월한 경도, 화학적 안정성 및 극한의 온도를 견딜 수 있는 능력의 직접적인 원인입니다.

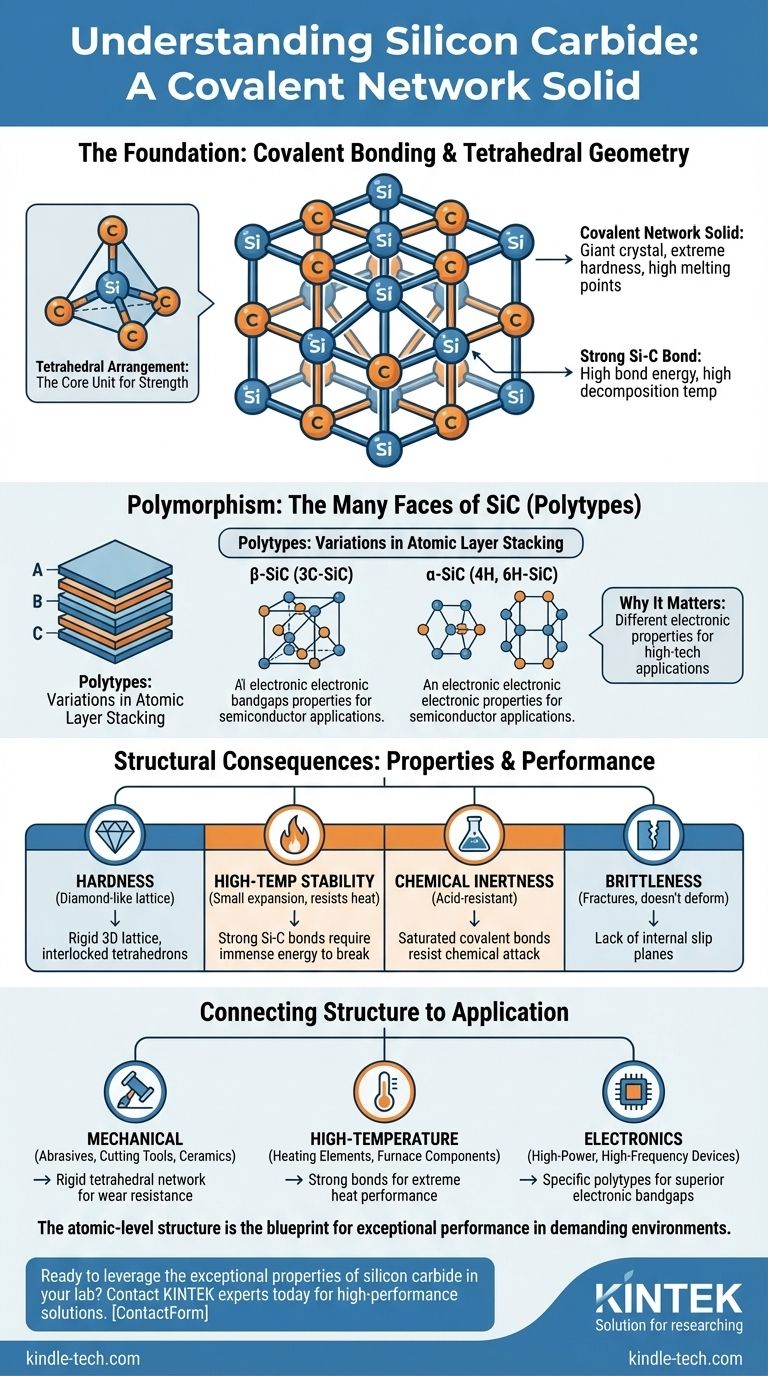
기초: 공유 결합 및 사면체 기하학
SiC를 이해하는 것은 원자 배열에서 시작됩니다. 자유롭게 움직이는 전자를 가진 금속이나 이온 결합으로 유지되는 염과 달리, SiC의 강도는 공유 결합을 통해 형성된 단일의 거대한 분자인 강력하고 공유된 전자 결합에서 비롯됩니다.
공유 결합 네트워크 고체란 무엇입니까?
공유 결합 네트워크 고체는 재료 전체에 걸쳐 연속적인 네트워크로 공유 결합에 의해 원자가 결합된 물질입니다. 개별적인 분자는 존재하지 않습니다.
전체 결정은 본질적으로 하나의 거대한 분자입니다. 이 구조는 다이아몬드 및 탄화규소와 같은 재료의 극심한 경도와 높은 녹는점의 원인입니다.
사면체 배열
SiC 격자에서 모든 실리콘 원자는 네 개의 이웃하는 탄소 원자와 화학적으로 결합되어 있습니다. 마찬가지로 모든 탄소 원자는 네 개의 이웃하는 실리콘 원자와 결합되어 있습니다.
이 배열은 매우 안정적이고 대칭적인 기하학적 형태인 사면체를 형성합니다. 이 상호 연결된 사면체의 반복적인 패턴은 믿을 수 없을 만큼 강력하고 단단한 골격을 만듭니다.
Si-C 결합의 강도
실리콘과 탄소 사이의 결합은 매우 강하고 비교적 짧습니다. 이 결합을 끊으려면 상당한 양의 에너지가 필요합니다.
이러한 높은 결합 에너지는 SiC의 높은 분해 온도(녹는 대신 승화함)와 극소수의 재료만이 능가하는 탁월한 경도의 직접적인 원천입니다.
다형성: 탄화규소의 다양한 모습
탄화규소는 단 하나의 구조가 아닙니다. 이는 다형성(polymorphism)이라는 현상을 나타내는데, 이는 동일한 화학식(SiC)을 유지하면서도 여러 가지 다른 결정 구조로 존재할 수 있음을 의미합니다. 이러한 다른 형태를 폴리타입(polytypes)이라고 합니다.
폴리타입 이해하기
폴리타입은 결정 내 원자 층의 적층 순서의 변형입니다. A, B, C로 표시된 원자 층을 쌓는다고 상상해 보십시오. 서로 다른 반복 패턴(예: ABCABC... 또는 ABAB...)은 서로 다른 결정 구조를 초래합니다.
화학적으로는 동일하지만, 이러한 폴리타입은 뚜렷한 물리적 특성, 그리고 가장 중요하게는 전자적 특성을 가질 수 있습니다.
주요 범주: α-SiC 및 β-SiC
알려진 수백 가지의 SiC 폴리타입은 크게 두 가지 주요 범주로 나뉩니다.
베타-SiC(β-SiC)는 섬아연석과 유사한 구조를 가진 입방 폴리타입(3C-SiC)을 나타냅니다. 알파-SiC(α-SiC)는 주로 육방정(4H-SiC 및 6H-SiC와 같은) 또는 능면체인 다른 모든 폴리타입을 포함합니다.
응용 분야에서 폴리타입이 중요한 이유
폴리타입의 존재는 단순한 학술적 세부 사항이 아니라 첨단 기술 응용 분야에 매우 중요합니다. 서로 다른 폴리타입은 서로 다른 전자 밴드갭을 가지며, 이는 반도체 특성을 결정합니다.
예를 들어, 4H-SiC 폴리타입은 고전력, 고주파 전자 장치에 선호되는데, 이는 해당 특정 목적에 대한 전자적 특성이 우수하여 첨단 반도체 분야에서의 사용을 뒷받침하기 때문입니다.
구조적 결과 이해하기
탄화규소에 대해 나열된 특성—경도, 안정성 및 내열성—은 모두 근본적인 원자 구조의 직접적인 결과입니다.
극도의 경도, 그러나 높은 취성
참고 자료는 SiC가 "단단하고 부서지기 쉽다"고 언급합니다. 극도의 경도를 제공하는 단단한 공유 격자는 또한 금속에서 발견되는 내부 슬립면이 부족하다는 것을 의미합니다.
결합이 견딜 수 있는 한계를 넘어서는 응력을 받으면, 원자가 서로 미끄러져 지나가도록 허용하여 변형될 수 없습니다. 대신, 이는 파국적으로 파손되는데, 이것이 취성의 정의입니다.
고온 안정성
강력한 Si-C 결합은 진동하고 분해되기 위해 막대한 열 에너지가 필요합니다. 이것이 SiC가 "작은 팽창 계수"와 "급랭 및 열에 대한 우수한 저항성"을 갖는다고 설명되는 이유입니다.
이러한 열 안정성은 대부분의 금속이 녹거나 변형되는 온도에서 구조적 무결성을 유지하기 때문에 고온 전기 발열체 및 용광로 부품에 이상적인 재료입니다.
화학적 비활성
참고 자료는 SiC의 "우수한 화학적 안정성"을 강조하며 "산에 대한 내성이 매우 강하다"고 언급합니다. 안정적인 포화 공유 결합은 화학 시약에 의해 쉽게 공격받거나 파괴되지 않습니다.
전자는 실리콘과 탄소 원자 사이에 단단히 고정되어 있어 산이나 다른 화학 물질이 반응할 기회가 거의 없으므로 매우 내구성이 뛰어나고 비반응성 재료가 됩니다.
구조와 응용의 연결
탄화규소의 원자 구조를 이해하면 자신감을 가지고 올바른 목적을 위해 이를 선택할 수 있습니다. 특성은 임의적인 것이 아니라 공유 결합 네트워크의 직접적인 결과입니다.
- 기계적 강도 및 내마모성이 주요 관심사인 경우: 단단하고 상호 연결된 사면체 네트워크는 SiC를 연마재, 절삭 공구 및 내구성 있는 구조용 세라믹에 이상적인 선택으로 만듭니다.
- 고온 성능이 주요 관심사인 경우: Si-C 결합을 끊는 데 필요한 높은 에너지로 인해 발열체, 용광로 부품 및 내화 재료에 완벽합니다.
- 첨단 전자 제품이 주요 관심사인 경우: 4H-SiC와 같은 특정 폴리타입의 뚜렷한 전자적 특성은 차세대 고전력 및 고주파 반도체 장치를 만드는 데 중요합니다.
궁극적으로 탄화규소의 원자 수준 구조는 세계에서 가장 까다로운 환경에서 탁월한 성능을 발휘하는 직접적인 청사진입니다.
요약표:
| 속성 | 구조의 결과 |
|---|---|
| 경도 | 상호 연결된 사면체의 단단한 3D 공유 격자 |
| 고온 안정성 | 강력한 Si-C 결합은 파괴를 위해 막대한 에너지가 필요함 |
| 화학적 비활성 | 포화된 공유 결합은 화학적 공격에 저항함 |
| 취성 | 단단한 격자 내 슬립면 부족으로 파손 발생 |
| 폴리타입 (예: 4H-SiC) | 서로 다른 원자 층 적층 순서로 첨단 반도체 응용 가능 |
실험실에서 탄화규소의 탁월한 특성을 활용할 준비가 되셨습니까?
KINTEK은 까다로운 환경에서 잘 작동하도록 제작된 고성능 실험실 장비 및 소모품을 전문으로 합니다. 귀하의 응용 분야가 극도의 내마모성, 고온 안정성 또는 첨단 반도체 기능을 요구하든 관계없이 재료 과학에 대한 당사의 전문 지식이 우수한 결과를 얻는 데 도움이 될 수 있습니다.
당사의 실리콘 카바이드 솔루션이 실험실의 효율성과 기능을 어떻게 향상시킬 수 있는지 논의하려면 지금 바로 전문가에게 문의하십시오.
시각적 가이드
관련 제품
- 첨단 응용 분야를 위한 전도성 질화붕소 BN 세라믹 복합재
- 전극 및 배터리용 전도성 탄소 천, 탄소 종이, 탄소 펠트
- 엔지니어링 첨단 파인 세라믹용 정밀 가공 지르코니아 세라믹 볼
- 실험실용 CVD 붕소 도핑 다이아몬드 소재
- 건식 및 습식 3차원 체질용 실험실 진동체 검기



















