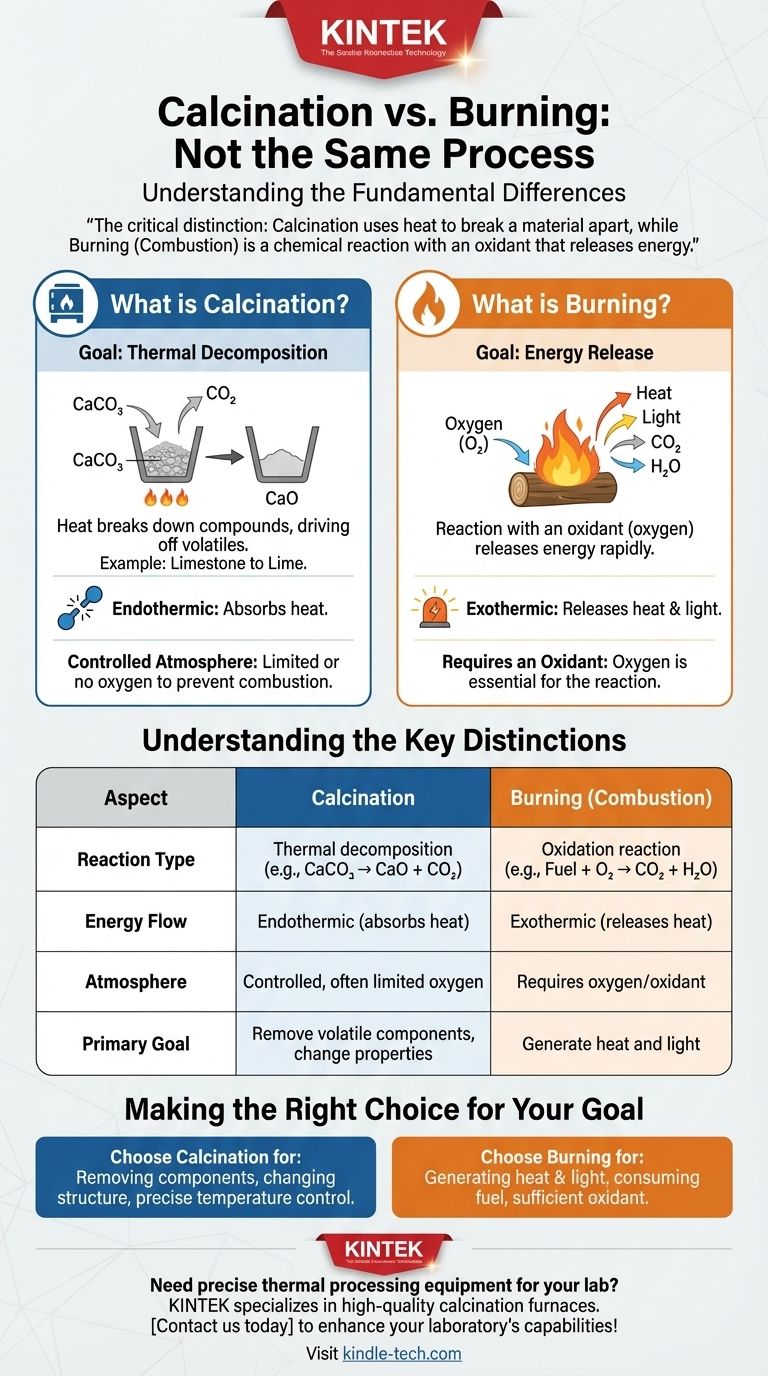
일반적인 오해와 달리, 소성은 연소 과정이 아닙니다. 둘 다 고온을 포함하지만, 근본적으로 다른 화학적 변형입니다. 소성은 열분해 과정으로, 열을 사용하여 화합물을 분해하고, 종종 이산화탄소나 물과 같은 휘발성 성분을 제거합니다.
핵심적인 차이점은 다음과 같습니다: 소성은 제어된 분위기에서 열을 사용하여 재료를 분해하는 반면, 연소는 산화제와(예: 산소) 반응하여 에너지를 방출하는 화학 반응입니다.
소성이란 무엇인가요?
소성은 재료의 화학적 및 물리적 특성을 변화시키는 데 사용되는 정밀한 열처리 과정입니다. 이 용어는 '석회를 태우다'라는 뜻의 라틴어 calcinare에서 유래했습니다.
목표: 열분해
소성의 주요 목적은 열분해를 유발하는 것입니다. 열은 물질 내의 화학 결합을 끊는 데 필요한 에너지를 제공하여 물질이 더 간단한 구성 요소로 분리되도록 합니다.
일반적인 예: 석회석에서 석회로
석회석에서 석회를 생산하는 것이 고전적인 예입니다. 석회석(탄산칼슘, CaCO₃)을 고온으로 가열하면 분해됩니다.
이 과정은 이산화탄소(CO₂) 가스를 배출하고, 시멘트 및 기타 산업 재료의 중요한 구성 요소인 석회(산화칼슘, CaO)를 남깁니다.
제어된 분위기의 역할
결정적으로, 소성은 종종 산소가 제한되거나 없는 분위기에서 발생합니다. 이는 특히 연소를 방지하고 원하는 분해 반응만 발생하도록 하기 위함입니다.

연소와 어떻게 다른가요?
화학적으로 연소라고 알려진 불타는 것은 연료와 산화제, 가장 일반적으로 공기 중의 산소 사이의 고온 발열 반응입니다.
산화제의 필요성
소성과 달리, 연소는 산화제 없이는 일어날 수 없습니다. 나무를 태울 때, 나무의 유기 화합물은 단순히 분해되는 것이 아니라 산소와 활발하게 반응합니다.
목표: 에너지 방출
연소의 주요 결과는 열과 빛의 형태로 에너지가 빠르게 방출되는 것입니다. 또한 새로운 화학 물질(재, 이산화탄소, 수증기 등)을 생성하지만, 에너지 방출이 그 특징을 정의합니다.
주요 차이점 이해하기
이 두 과정을 혼동하면 재료 처리, 화학 및 공학에서 심각한 오류로 이어질 수 있습니다. 차이점은 명확하고 절대적입니다.
반응 유형
소성은 분해 반응입니다. 단일 화합물이 두 개 이상의 더 간단한 생성물로 분해됩니다(예: CaCO₃ → CaO + CO₂).
연소는 산화 반응입니다. 연료가 산화제와 반응하여 새로운 산화 생성물을 형성합니다(예: CH₄ + 2O₂ → CO₂ + 2H₂O).
에너지 흐름
소성은 일반적으로 흡열 과정입니다. 반응을 유지하고 화학 결합을 끊기 위해 지속적인 에너지(열) 입력이 필요합니다.
연소는 발열 과정입니다. 일단 시작되면, 시작하는 데 필요했던 것보다 훨씬 더 많은 에너지를 방출하여 자가 유지 반응을 만듭니다.
목표에 맞는 올바른 선택
소성할지 연소할지 이해하는 것은 모든 열처리 과정에서 원하는 결과를 얻는 데 근본적입니다.
- 고체에서 특정 구성 요소(예: 물 또는 CO₂)를 제거하거나 결정 구조를 변경하는 것이 주요 목표인 경우: 정밀한 온도 제어 및 분위기 관리가 중요한 소성을 수행하고 있습니다.
- 연료를 소비하여 열과 빛을 생성하는 것이 주요 목표인 경우: 공기와 같은 산화제의 충분한 공급을 보장하는 것이 주요 우선 순위인 연소를 수행하고 있습니다.
이 두 가지 기본적인 과정을 구별하는 것은 화학 반응을 제어하고 재료를 효과적으로 공학하는 데 필수적입니다.
요약표:
| 측면 | 소성 | 연소 |
|---|---|---|
| 반응 유형 | 열분해 | 산화 반응 |
| 에너지 흐름 | 흡열 (열 흡수) | 발열 (열 방출) |
| 분위기 | 제어된, 종종 제한된 산소 | 산소/산화제 필요 |
| 주요 목표 | 휘발성 구성 요소 제거, 재료 특성 변경 | 열과 빛 생성 |
실험실을 위한 정밀한 열처리 장비가 필요하신가요? KINTEK은 제어된 열분해를 위해 설계된 고품질 소성로 및 실험실 장비를 전문으로 합니다. 당사의 솔루션은 재료 변형을 위한 정확한 온도 제어 및 분위기 관리를 보장합니다. 지금 문의하세요 실험실의 역량을 강화하세요!
시각적 가이드
관련 제품
- 회전식 튜브 퍼니스 분할 다중 가열 구역 회전식 튜브 퍼니스
- 진공 밀봉 연속 작동 회전 튜브로 진공 회전 튜브로
- 실험실 진공 틸트 회전 튜브 퍼니스 회전 튜브 퍼니스
- 활성탄 재생용 전기 회전 가마 소형 회전로
- 실험실용 고속 열처리(RTP) 석영관 로



















